¿Es la primera que vez que das Química? ¿Has vuelto a estudiar y te está constando reenganchar con las ciencias? Antes de ponerte a hacer problemas como un loco o leer páginas y páginas de teoría, lo mejor es que te familiarices con términos químicos y conceptos básicos de química.
Aunque partas de un nivel bajo, con un vocabulario adecuado mejorarás tu comprensión de la química. La química para principiantes requiere inevitablemente aprender nuevas palabras y entender cada concepto para poder ir profundizando cada vez más.

Estructura de la materia
La química, básicamente, es el estudio de los átomos, los elementos, los compuestos y las moléculas. Estos son los cuatro términos que debes conocer para empezar. Pero, ¿a qué se refieren? Es una pregunta importante, ya que estos cuatro elementos (y la materia de la que están hechas) constituyen todo en el universo.
⚛️ Átomo y sus partículas
- Átomo: partícula indivisible por métodos químicos, formada por un núcleo rodeado de electrones. Te recomendamos que te dirijas al apartado «partícula» para entender completamente de qué están formados los átomos.
- Partícula: los átomos están hechos de partículas, que se agrupan en el núcleo del átomo o giran alrededor de ese núcleo. Estas partículas tienen una carga positiva, neutra o negativa. El núcleo (el centro del átomo) contiene los protones, que tienen carga positiva, y los neutrones, que son neutros. Los electrones tienen carga negativa y giran alrededor del núcleo.
- Protón: partícula con carga eléctrica positiva, que forma parte del núcleo del átomo.
- Electrón: partícula elemental con carga eléctrica negativa.
- Neutrón: Partícula sin carga eléctrica, que forma parte del núcleo del átomo.
- Neutrón lento: neutrón con velocidad del mismo orden que la agitación molecular a temperatura normal.
- Neutrón rápido: neutrón de velocidad comparable con la de la luz.
- Molécula: son dos (o más) átomos unidos, o enlazados, entre sí. Así, mientras que un átomo de oxígeno no es una molécula, si dos átomos de oxígeno se unen, eso sí es una molécula (lo que llamaríamos O2).

Si estás estudiando para conseguir el título de la ESO o si necesitas ponerte al día antes de tus exámenes de bachillerato, ¡echa un vistazo a este diccionario de introducción a la química!
🔢 Tabla periódica y elementos químicos
- Número atómico: con el número atómico nos referimos al número de protones de un átomo y, por lo tanto, de electrones, ya que son los mismos.
- Número másico: el número de protones más el número de neutrones.
Número másico (A) = número atómico (Z) + número de neutrones(N)
A = Z + N
- Elementos: es una sustancia pura o algo que no se puede descomponer en otra sustancia. Solo puede descomponerse en átomos, es decir, en las porciones más pequeñas del elemento. Un elemento es una gran cantidad del mismo átomos. ¿Qué hay de las moléculas y los compuestos? Son ligeramente diferentes. Ve hasta la letra M o C para encontrar el término «molécula» y «compuesto» respectivamente.
Se conocen 110 elementos, de los cuales 87 son metales, 27 son radiactivos, 16 son artificiales (radiactivos), 11 son gases y 2 son líquidos.
- Elemento de transición: elementos que aparecen en los grupos tres a doce de la tabla periódica. También conocidos como metales de transición.
- Tabla periódica: es la tabla de los elementos, ordenados según el número atómico. Fue inventada por Mendeleev.
Comprender los términos de los libros de texto que usas en tu clase de Química no solo implica conocer las estructuras atómicas de los estados de la materia. También debes conocer las formas en las que un químico puede hacer un cálculo o medir una sustancia determinada. Esta terminología imprescindible te será de ayuda en cualquier clase de química.
Seguro que la has visto en cualquier laboratorio de química. Este es uno de los descubrimientos químicos más importantes.
Aquí te dejamos la tabla periódica. No dudes en descargar la imagen y descargarla, si aún no la tienes.
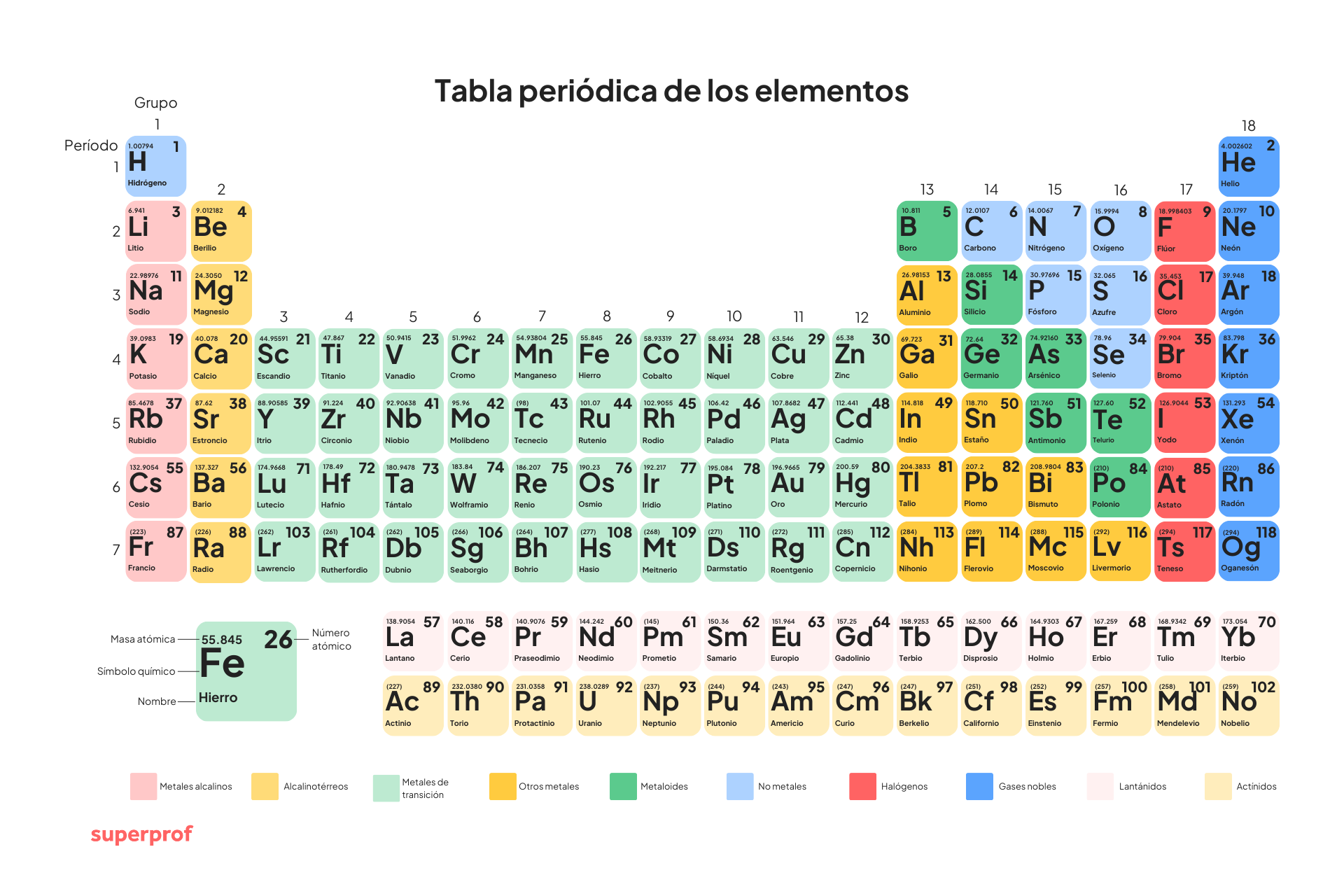
- Metal: en física y química, con la palabra «metal» nos referimos a los elementos químicos que son buenos conductores del calor y de la electricidad; que además tienen un brillo característico, son sólidos a temperatura ordinaria (salvo el mercurio) y que en sus sales en disolución forman iones electropositivos o cationes. Se dice que los metales son aquellos elementos a los que les gusta perder electrones, formando enlaces y desarrollando cargas positivas.
- Metal pesado: elementos metálicos con número atómico mayor a 20, como, por ejemplo, el mercurio y el plomo. Pueden dañar a organismos vivos en bajas concentraciones y tienden a acumularse en la cadena alimenticia.
¿Conoces las clases particulares química en Madrid de Superprof?
Enlaces y reacciones químicas
El término enlace se refiere a la unión de dos átomos en un compuesto químico. Existen diferentes tipos de enlaces:
🔗 Tipos de enlaces químicos
- Enlace covalente: en los enlaces covalentes, dos átomos comparten un par (o más de un par) de electrones.
- Enlace iónico: en los enlaces iónicos, un átomo dona un electrón a otro. Cuando esto sucede, el átomo donante se convierte en un ion: se carga positivamente.
Teniendo esto claro, podrás entender otros términos químicos:
- Compuestos: los compuestos son moléculas que tienen enlaces entre dos tipos diferentes de átomos. En este caso, si se añade un átomo de carbono al O2, se obtiene CO2, el dióxido de carbono, que es un compuesto. Existen diferentes tipos de compuestos:
- Hidrocarburos: son compuestos orgánicos, que contienen, como sugiere el término, solo hidrógeno y carbono.
- Polímeros: moléculas grandes, ya sean naturales o sintéticas y producidas en un laboratorio, que están formadas por muchas moléculas más pequeñas unidas (a menudo hidrocarburos).
- Sales: compuestos iónicos cuya carga se neutraliza. Combina iones con carga positiva con los de carga negativa.
- Mezcla: no confundir el término mezcla con compuesto. Las sustancias pueden ser elementos puros, compuestos o mezclas. En química, una mezcla se define como una sustancia compuesta por dos o más elementos combinados, pero no enlazados químicamente como un compuesto.
Estos serían los conceptos básicos de química, por lo que intenta entenderlos bien.
💥 Reacciones químicas
Una reacción química es un proceso mediante el cual se transforman unos compuestos químicos en otros con producción o consumo de energía. Es crucial que aprendas la terminología esencial de procesos y reacciones químicas, ya que son utilizados frecuentemente.

En primer lugar, debes conocer los tres términos de una reacción química, que son:
- Reactivo: sustancia que está presente al inicio de la reacción.
- Catalizador: sustancia que da lugar a la reacción, pero que no cambia.
- Producto: lo que obtienes al final de la reacción.
Todas las reacciones son endotérmicas o exotérmicas, lo que significa que o bien toman energía o la distribuyen.
En esta tabla, encontrarás algunas palabras importantes relacionadas con los principales tipos de reacción:
| Oxidación | Una reacción, generalmente con oxígeno, en la que se pierde un electrón. |
|---|---|
| Reducción | Cuando se añaden electrones a un átomo (lo contrario de lo anterior). |
| Destilación | Cuando una mezcla pierde un líquido por evaporación y condensación. |
| Descomposición Térmica | Romper un compuesto en dos o más sustancias mediante calor. |
| Valoración | Si conoces la concentración de una solución, puedes utilizar la valoración para determinar la concentración de una solución diferente. |
Para aprobar tus exámenes de química, tendrás que conocer algunos términos básicos de las reacciones químicas, ¡o nunca comprenderás lo que sucede en un laboratorio o en un experimento! ¡La química es divertida!
- Ácido: dicho de una solución que tiene un pH inferior a 7. Los ácidos contienen hidrógeno, donan protones y producen iones positivos en el agua.
- Básico: dicho de una solución que tiene un pH superior a 7. Las bases producen iones negativos en el agua.
- pH: grado de acidez de una sustancia. Las sustancias que no son ácidas se llaman básicas. La escala varía de 0 a 14, teniendo el más ácido el número más bajo y el más básico el más alto. Las sustancias neutras tienen pH7.
- Clasificación de las reacciones
- Ácido-base. Se llaman así porque existe un intercambio de protones H+ y oxhidrilos HO-.
- Óxido-reducción. Son reacciones de transferencia de electrones. El Mg pierde 2 electrones, se oxida, y el oxígeno gana 2 electrones, se reduce.
- De precipitación. Donde el producto de reacción es un sólido que precipita (tiende a decantar en el fondo del recipiente). Por ejemplo: NaCl + Ag NO3 → AgCl ↓ + NaNO3
- De complejación. Generalmente se obtiene con cationes de elementos situados en el centro de la tabla periódica, y aniones capaces de capturar el catión, formando una molécula o anión complejo muy estable. Por ejemplo: Cu2⁺ + 4 Cl⁻ → [ Cu Cl4 ]⁼
- Ley de conservación de la masa: también denominada Ley de Lavoisier, explica que «La materia ni se crea ni se destruye, solo se transforma.» Antoine Lavoisier es uno de los químicos más importantes de la historia.
- COD: son las siglas en inglés de Chemical Oxygen Demand, que se traduce como Demanda Química de Oxígeno. Es la cantidad de oxígeno que se requiere para lograr la oxidación completa de los compuestos químicos orgánicos en agua. Es utilizada como una unidad de medida del nivel de contaminantes orgánicos en las aguas residuales y naturales.
- COPs: son las siglas de Contaminantes Orgánicos Persistentes y se refiere a químicos orgánicos que permanecen en el medio ambiente por un periodo largo de tiempo y son dañinos a los organismos que viven es ese medio.

Estados de la materia y propiedades químicas
Las moléculas forman sustancias, que se pueden encontrar en tres estados diferentes. Probablemente ya los haya escuchado, pero es importante recordar que una sustancia puede cambiar su estado debido al calor y la presión. Cuando hablamos de estado de la materia nos referimos a algunos de los tres siguientes:
💨 Gas 💨
💧 Líquido 💧
🧊 Sólido 🧊
Cuanto un elemento pasa de un estado a otro se denomina con un término específico. Recordémoslos:
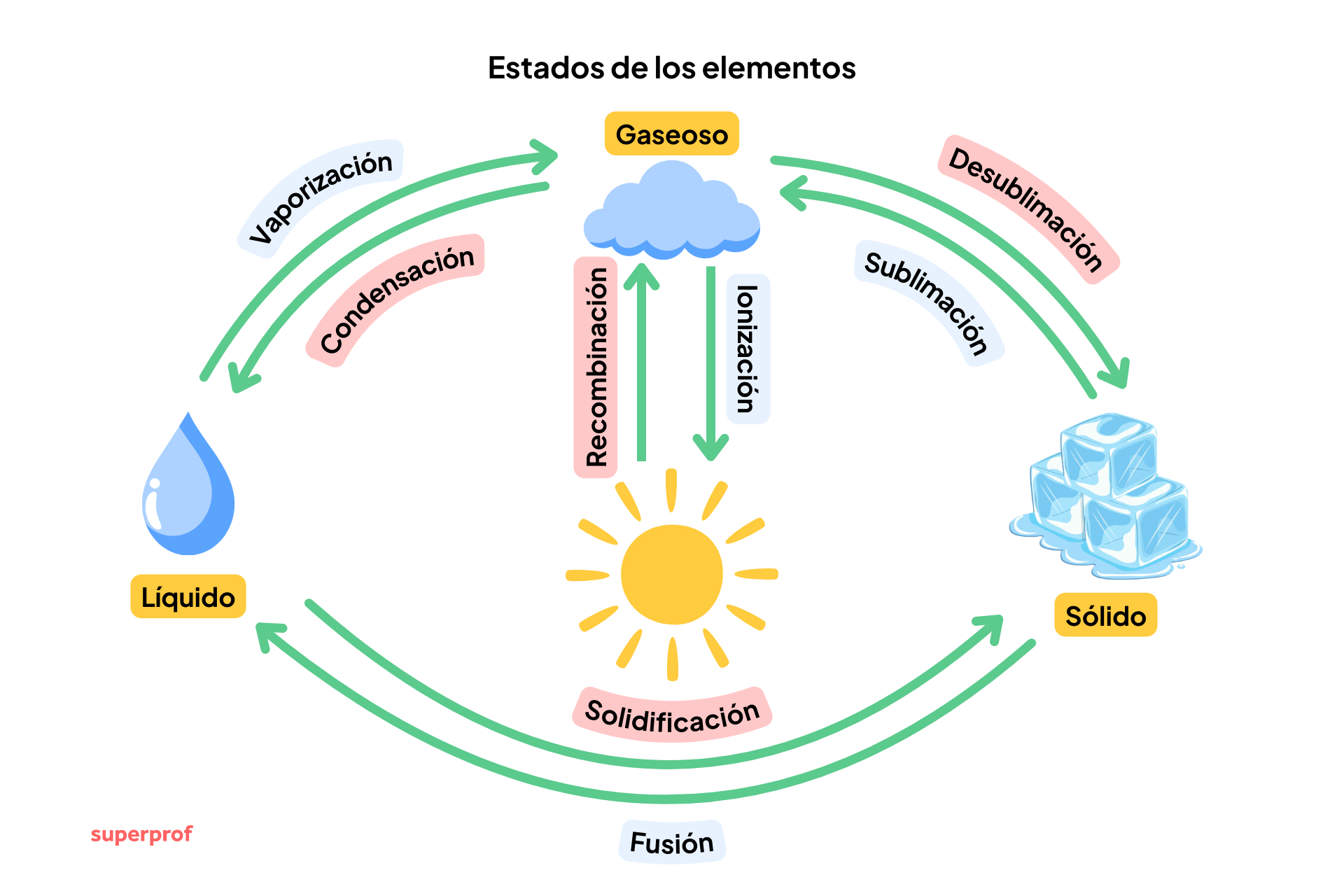
- De sólido a líquido → fusión
- De líquido a gas → vaporización
- De gas a líquido → condensación o licuación
- De líquido a sólido → solidificación
- De sólido a gas → sublimación o volatilización
- De gas a sólido → desublimación
Cabe explicar que cuando un líquido se vaporiza, es decir, pasa a ser gas, se puede producir de dos formas distintas:
Mediante evaporación la vaporización se da solo desde la superficie libre del líquido y a cualquier temperatura. O ebullición, cuando la vaporización se da desde todo el interior del líquido y a una temperatura dada, que depende del líquido y de la presión externa.
Si buscas un profesor de química a domicilio, encuéntralo en Superprof.
🌡️ Estados de la materia
- Sólidos: los sólidos son las sustancias que son más estables, con moléculas más compactas. Tienen una forma más fija y un volumen definido.
- Líquidos: los líquidos son sustancias que son fluidas, sin forma fija pero con un volumen definido.
- Gases: los gases son sustancias sin forma fija ni volumen definible.
🏗️ Propiedades de la materia
Seguimos con los conceptos básicos de la química general. La materia es todo aquello que ocupa lugar en el espacio y posee masa. Todos los sistemas materiales están formados por átomos y moléculas. En los apartados correspondientes te explicamos cada término.
Las propiedades de la materia pueden clasificarse en:
- Extensivas: aquellas que dependen de la cantidad de materia considerada. Ejemplos: el peso y el volumen.
- Intensivas: aquellas que no dependen de la cantidad de materia considerada. Ejemplos: la densidad, el punto de fusión, el punto de ebullición, el peso específico.
Aprende todo esto en nuestras clases de quimica.
Algunas propiedades de la materia son:
- Densidad: relación entre la masa de un cuerpo y el volumen que ocupa.
- Conductividad: capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí mismo.
- Reactividad química: Se refiere a la capacidad de reaccionar de un determinado elemento. Cada elemento de la tabla periódica reacciona de una forma distinta respecto a diferentes procesos y junto con una variedad de materiales. ¡Cuidado con la reactividad de ciertos elementos con otros! Igual tu habitación acaba echando humo...
Gases y leyes químicas
El gas es uno de los estados de la materia que más curiosidad causa a los científicos porque no podemos ver la materia en este estado.

💨 Gases y sus propiedades
- Gases ideales: se denomina gas ideal a un gas hipotético o teórico, que estaría compuesto por partículas que se desplazan aleatoriamente y sin interactuar entre sí.
La energía cinética de este tipo de gas es directamente proporcional a la temperatura. Las colisiones entre las moléculas que lo componen (entre sí y con el recipiente o contenedor) son de tipo elástico, es decir, que conservan el momento y la energía cinética.
La Ley de los gases ideales es:
p x V = n x R x T
En la que:
p = presión. Se mide en Pascales (Newton/m2); atmósferas (1 atm = 101325 Pa); milímetros de mercurio o Torricelis (760 mmHg = 1 atms) o Bar (1 bar =100000 Pa)
V = volumen. Se mide en metros cúbicos (SI) o en litros (1000 L = 1 m³)
n = moles
R = constante de los gases ideales. 0,08206 L atm mol-1 K-1. 8,3145 J mol-1 K-1
T = temperatura. Se mide en Kelvin (T(K) = T(°C) + 273.15)
- Gases de efecto invernadero: los gases de efecto invernadero (GEI) son gases emitidos de forma natural o antropogénica, es decir, emitidos por la actividad humana. La presencia de estos gases es que son contaminantes y contribuyen al calentamiento global, lo que acelera el cambio climático en el planeta Tierra. Los principales gases de efecto invernadero son:
- Dióxido de carbono (CO2)
- Metano (CH4)
- Óxido nitroso (N2O)
- Clorofluorocarbonos (CFC)
- Ozono troposférico (O3)
- Vapor de agua (H₂O)
¿Y si pruebas con algún profesor de química en línea?
- Gases traza: son los gases que constituyen la atmósfera, pero en menor medida. En cantidad se sitúan en menor medida después de los dos gases mayoritarios que hay en la atmósfera: el nitrógeno y el oxígeno. Junto con estos dos gases forman el 99 % de todo el volumen. Por ejemplo, los gases traza más importantes que contribuyen al efecto invernadero son: dióxido de carbono (CO2), ozono (O3), metano (CH4), óxido nitroso (N2O), perfluorocarbonos (PFC), clorofluorocarbonos (CFC), hidrofluorocarbonos (HFC), hexafloururo de azufre (SF6) y vapor de agua (H2O).
- Combustibles fósiles: combustibles basados en carbono procedentes de depósitos de hidrocarburos fósiles, lo que incluye el carbón, la turba, el petróleo y el gas natural.
- Ciclo del carbono: término que describe el flujo de carbono en la atmósfera, el océano, la biosfera terrestre y marina y la litosfera. El carbono es el principal componente químico de la mayor parte de la materia orgánica.

¿No te estás enterando de nada? ¡Mejor contrata a un profesor particular de quimica!
📏 Leyes de los gases
- Ley de Boyle: la ley de Boyle-Mariotte relaciona el volumen y la presión, y dice que: la presión ejercida por una masa de un gas ideal es inversamente proporcional al volumen que ocupa cuando la temperatura y la cantidad de gas permanecen invariables.
- Ley de Dalton: la ley de Dalton de proporciones parciales establece que, a una temperatura estable, la presión total de una mezcla de gases que no reaccionan químicamente entre sí, es igual a la suma de las presiones parciales que ejercería cada uno de sus componentes. La presión ejercida por cada componente individual de la mezcla de gases se denomina presión parcial. Se aplica a mezclas de gases que no reaccionan. Por ejemplo, el aire. Ptotal = Pa + Pb + Pc + ...
Términos de laboratorio en química
En este glosario de términos químicos no podía faltar una lista de palabras relacionadas con el equipo científico que se usa en los laboratorios. La química no es solo teórica y analítica, sino también empírica y, por tanto, práctica.
🧪 Equipos de laboratorio
- Mechero Bunsen: se trata de un mechero ideado para crear un área estéril. Usarlo será una de las mejores experiencias en tus clases de química del instituto. Al conectarlo a un grifo de gas, obtienes calor y una llama para hacer tus experimentos de química.

- Tubo de ensayo: el instrumento más emblemático de la química: es un tubo delgado en el que realizarás experimentos con tus soluciones. Un tubo de ebullición es una variedad más grande del tubo de ensayo, en el cual, ¡lo has adivinado!, puedes hervir cosas.
- Buretas: las buretas son como tubos de ensayo, pero tienen medidas y se sujetan con abrazaderas para que puedas añadir gotas de la solución. Se utilizan principalmente para las valoraciones. No solo se usa en química, sino también en biología y medicina.
📐 Unidades y medidas en química
- Mol: unidad utilizada para identificar una determinada cantidad de sustancia. Un mol de cualquier sustancia contiene el mismo número de átomos que un mol de otra sustancia.
- Masa atómica: masa total de protones y neutrones en un átomo.
- Masa molecular: masa de una molécula, que puede estar formada por varios átomos.
| 🔬 Término | 📖 Definición |
|---|---|
| Ácida | Solución que tiene un pH inferior a 7 |
| Átomo | Partícula indivisible por métodos químicos, formada por un núcleo rodeado de electrones |
| Básica | Solución que tiene un pH superior a 7 |
| Bureta | Tubo para contener un líquido y verterlo de forma dosificada |
| Conductividad | Capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí mismo |
| Densidad | Relación entre la masa de un cuerpo y el volumen que ocupa |
| Electrón | Partícula elemental con carga eléctrica negativa |
| Elemento | Sustancia pura o algo que no se puede descomponer en otra sustancia |
| Enlace covalente | Dos átomos comparten un par (o más de un par) de electrones |
| Enlace iónico | Un átomo dona un electrón a otro. Cuando esto sucede, el átomo donante se convierte en un ion: se carga positivamente |
| Gas ideal | Gas que estaría compuesto por partículas que se desplazan aleatoriamente y sin interactuar entre sí |
| Hidrocarburos | Compuestos orgánicos, que contienen, como sugiere el término, solo hidrógeno y carbono |
| Mechero Bunsen | Mechero ideado para crear un área estéril |
| Metales | Elementos químicos que son buenos conductores del calor y de la electricidad |
| Mol | Unidad utilizada para identificar una determinada cantidad de sustancia. Un mol de cualquier sustancia contiene el mismo número de átomos que un mol de otra sustancia |
| Molécula | Son dos (o más) átomos unidos, o enlazados, entre sí. Así, mientras que un átomo de oxígeno no es una molécula, si dos átomos de oxígeno se unen, es una molécula |
| Polímeros | Moléculas grandes, ya sean naturales o sintéticas, y producidas en un laboratorio |
| Protón | Partícula con carga eléctrica positiva, que forma parte del núcleo del átomo |
| Reactivo | Sustancia que está presente al inicio de la reacción |
| Sales | Compuestos iónicos cuya carga se neutraliza |
¡Con estos términos de química básica1 ya sabes un poco más de química! Recuerda: la química está presente en nuestra vida diaria, así que seguro que estos términos y conceptos te son de utilidad. Si puedes complementar lo que aprendes en el instituto/universidad con las clases de quimica particulares, notarás la diferencia.
Bibliografía
- «Conceptos básicos en Química». Universitat de València. Fecha de última consulta: 21 de abril de 2025. Disponible en: chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.uv.es/tunon/Master_Ing_Bio/tema_1.pdf
Resumir con IA:
















Me encanta y además es entendible
¡Gracias leernos! Nos encanta saber que te ha gustado :)
Si me sirbio
¡Nos alegra saber que te fue útil! 😊 Si necesitas más ayuda con química, ¡aquí estamos! 🧪✨
muy interesante informacion de calidad
Muy útil 🥰
¡Me alegra mucho que te haya sido útil! 🧪🥰 Si tienes más preguntas sobre química o cualquier otro tema, no dudes en preguntar. ¡Estoy aquí para ayudarte! 😊✨
Hola cómo estás palabras por la w que tengas que ver con química
EXELENTE
¡Muchas gracias, Ángel!
Quero mas ejemplo 500 ejemplo quero
Me falta J -K- U- V -W- X -Y- Z
Es Muy Bueno
Gracias me ayudo mucho 🥰👍
Nos alegra saberlo 💛 Gracias por tu comentario.
Me gustó pero para la próxima un poquito más resumida que me duele la mano de tanto escribir
¡Gracias por el comentario! 😊 Tomamos nota para hacerlo aún más breve en el futuro. ¡Que disfrutes la lectura! 📚✨