Capítulos
A inicios del siglo XX se tenían una cantidad de problemas para los cuales la física no tenía respuesta, como el problema gravitatorio de tres cuerpos, u otros más fundamentales a nivel microscópico como los átomos, que al analizarlos con las herramientas disponibles se obtenían soluciones erróneas, o en el peor de los casos no podían ser estudiados con las teorías de ese entonces.
Lo anterior obligo a que se cuestionara si la física era una ciencia completa como se pensaba a finales del siglo XIX. Después de varias décadas de trabajo intenso varios científicos como Heinrich Hertz, Ernest Rutherford, J. J. Thomson, Niels Bohr, Marie Curie, Werner Heisenberg, Erwin Schrödinger, Paul Dirac, Louis-Victor de Broglie, Albert Einstein, Max Born, Max Planck y Wolfgang Pauli establecieron una nueva teoría física para describir el comportamiento de microsistemas como átomos, moléculas y cristales. Esta nueva teoría es la física cuántica.
En la física cuántica, las leyes de Newton con sus certezas (determinismo) y la teoría electromagnética de Maxwell que consideraba la luz como una onda electromagnética transversal que no necesitaba ningún medio material para propagarse, fueron sustituidas por las ecuaciones de Schrödinger y las construcciones matemáticas de Heisenberg que hablaban de la indeterminación.

Fenómenos de física cuántica
A finales del siglo XIX la mayoría de los conceptos fundamentales en física estaban completamente determinados, siendo la teoría electromagnética de Maxwell la que fundamentaba las interacciones eléctrica y magnética; sin embargo existían algunos fenómenos que no podían ser explicados con esta teoría.
Los fenómenos que permitieron la formulación de la física cuántica están relacionados con la absorción y/o emisión de ondas electromagnéticas por los átomos que constituyen la materia. Los tres principales fenómenos son: el espectro de emisión del cuerpo negro, el efecto fotoeléctrico y los espectros de los gases.
Espectro de emisión del cuerpo negro
La temperatura de un cuerpo puede ser estudiada a traves de la radiacción electromagnética que emite el cuerpo, la cual es conocida como radiación térmica.
Un cuerpo negro es un cuerpo que absorbe toda la radiacción que le llega sin reflejar nada. Por la ley del equilibrio térmico, un cuerpo negro es un emisor ideal, esto es, emite todas las longitudes de onda.
El estudio del cuerpo negro condujo a importantes leyes:
1Ley de Stefan-Boltzmann: La cantidad total, por unidad de tiempo y superficie, de energía emitida por un cuerpo negro es proporcional a la cuarta potencia de la temperatura absoluta.
2Ley del desplazamiento de Wein: El cuerpo negro emite energía para todas las longitudes de onda y la distribución de la energía radiante es tal que a una determinada longitud de onda la intensidad de emisión es máxima.
3Ley de Rayleigh-Jeans: La cantidad de radiación emitida en un rango de frecuencia dado, debe ser proporcional al número de ondas estacionarias en ese rango. Este resultado se ajustaba perfectamente a altas longitudes de onda, pero no para longitudes pequeñas donde contradecía la ley de Stefan-Boltzmann; a esto se le conoció como la catástrofe ultravioleta.
4Ley de Planck: la energía de las ondas electromagnéticas no es divisible indefinidamente sino que se radia en unidades pequeñas de energía denominadas cuantos, siendo la energía de cada cuanto proporcional a la frecuencia de la radiación. Por tanto, la radiación emitida o absorbida por un cuerpo sólo puede ser un número entero de cuantos.
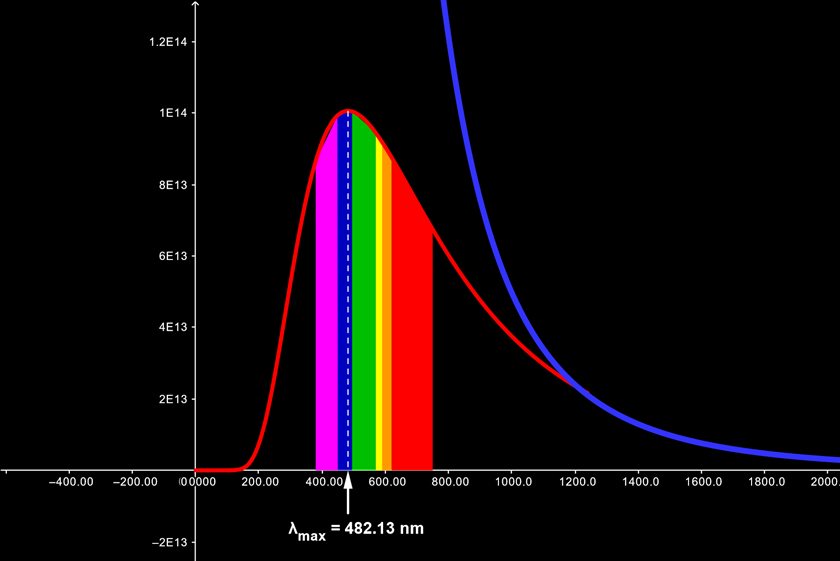
En la siguiente figura en color rojo se ilustra la ley de Planck donde lo experimental coincide con lo teórico, y en color azul la ley de Rayleigh-Jeans que da origen a la catástrofe ultrvioleta
Efecto fotoeléctrico
El efecto fotoeléctrico es la emisión de electrones por algunos metales cuando inciden en ellos luz ultravioleta, generando así corriente eléctrica. Este fenómeno tiene las siguientes características:
1 La energía de los electrones emitidos es independiente de la intensidad de la luz incidente.
2 La energía cinética de los electrones emitidos es proporcional a la frecuencia de la luz excitadora, existiendo un frecuencia umbral mínima para que se produzca la emisión.
3 Los electrones se emiten de forma instantánea cuando la frecuencia de la radiación supera la frecuencia umbral mínima.
Lo anterior indica que la luz cede energía a los electrones del metal, pero no se podía emitir electrones hasta que se superara la frecuencia umbral mínima y la energía sobrante se emplea en aumentar la energía cinética de los electrones emitidos.
Con la teoría clásica disponible en ese entonces, ninguna de las características anteriores podía ser explicada. No fue hasta 1905 que Einstein propuso una explicación para los hechos expuestos: la luz está formada por pequeños cuantos de energía que más adelante se llamarían fotones. La energía de los cuantos luminosos está ligada con su frecuencia según la hipótesis de Planck.
Al chocar un foton con un electrón y si la energía del fotón era suficiente, el electrón era arrancado instantáneamente, independientemente del resto de fotones de la luz incidente.
Espectros de los gases
Si se encierra gas en un tubo y se somete a voltajes elevados, la teoría clasica indicaba que los espectros de luz deberían de ser continuos; sin embargo los experimentos realizados mostraban que los espectros de los átomos eran discontinuos.
En 1912 Niels Bohr observó que las ecuaciones de Maxwell parecían implicar el colapso del modelo orbital del átomo de hidrógeno, mostrando que las leyes de la física clásica estaban equivocadas.
En 1913 Bhor propuso un modelo en el que el electrón solamente se podía mover en pocas órbitas permitidas que corresponden a niveles de energía bien definidos, ete solo puede absorver energía en cuantos y al absorver un número adecuado de energía a un nivel más alto; por el contrario, los electrones en niveles superiores pueden cambiar espontáneamente hacia abajo y al hacerlo emiten cuantos de luz que pueden ser observados ya que poseen longitudes de onda específicas que corresponden a las líneas espectrales. Desafortunadamente, el modelo de Bhor solamente aplica para el átomo de hidrógeno, pero dió pie al desarrollo de la física cuántica.
Desarrollo de la física cuántica
En 1924 De Broglie presentó en su tesis doctoral una relación, modelada en la de Planck, entre el momento
clásico de un electrón (masa por velocidad) y la longitud de onda de la onda correspondiente, esto es, los electrones son partículas que se comportan como ondas. Cabe señalar que un examinador de la tesis De Broglie fue Einstein a quien le pareció muy interesante. Años más tarde, De Broglie recibió el premio nobel de física.
En 1925 Schrödinger, desarrollando la teoría de De Broglie, considera al electrón como una onda e intenta
obtener la correspondiente ecuación. propone la llamada ecuación de onda para un electrón que describe su comportamiento en el átomo de hidrógeno cuya solución permite obtener la llamada función de
onda para el electrón u orbital atómico y su energía.
En 1927 Heisenberg, inspirado en los trabajos de Bhor y apoyado en el álgebra matricial, enuncia el llamado Principio de Incertidumbre o Principio de Indeterminación: Existen ciertos pares de magnitudes físicas (aquellas cuyo producto tenga las mismas dimensiones que la constante de Planck) que no pueden ser medidas de forma simultánea con total exactitud, ya que debe cumplirse que el producto de la indeterminación de las medidas debe ser igual o mayor que la constante de Planck entre cuatro veces pi.
El álgebra matricial aplicada al formalismo de Heisenberg (llamada mecánica matricial) condujo a la primera disposición concreta de la física cuántica, ya que no sólo aplicó al caso del átomo de
hidrógeno, sino también a otros sistemas microscópicos simples donde las soluciones obtenidas
teóricamente coincidían con los datos experimentales.
Resumir con IA:













Profesor Gaspar. Como puedo tener Coordenadas a traves del Espacio Exterior, para conocer por ejemplo la posible ubicacion de una tripulacion. Gracias Profesor.
Hola tu pregunta es muy interesante, para tener coordenadas en el espacio tendrías que tomar un cuerpo celeste, un sistema solar u otra cosa como referencia, podría ser también el sol o el planeta tierra y a partir de allí te podrías guiar, usando la forma rectangular, cilíndrica o esférica.
Un cordial saludo. Con respecto a la Constante de Planck, y asumiendo que puede ser un tema “interesante” a colegiar, quiero compartir la siguiente “observación”:
Si tenemos en cuenta que:
1ro- En los eventos de comportamiento Oscilatorio está conceptualizado claramente que la “frecuencia” es la cantidad de Oscilaciones que ejecuta la onda en un intervalo de tiempo determinado (por ejemplo, “20 Oscilaciones/segundo”) aunque por motivos prácticos en las ecuaciones aparezca anotada generalmente en la unidad “1/segundo”, lo cual tiene su origen en que el “periodo” se expresa también habitualmente en “segundos” (PERO, su unidad de medida conceptualmente rigurosa es “tiempo/Oscilación”)
2do- En base a lo anterior si ahora se procediera a anotar la “frecuencia” en su unidad “académicamente rigurosa” para enunciar la Ecuación Cuántica de la Energía de un fotón ( E = h x f ), entonces para que la unidad de medida de la Energía (E) quede en su unidad (por ejemplo, “Joules”) la unidad de medida de la Constante de Planck tendría que ser “(Joules x segundo)/OSCILACIÓN” (?!)
Un cordial saludo. Con respecto a las discusiones ontológicas sobre la Mecánica Cuántica, se puede «demostrar» que su causa básica radica en el hecho de que «la unidad de medida de la Constante de Planck adolece de un término, y que al ser agregado se nos revela de manera plena el verdadero significado físico de esta Constante, y a la vez se solucionan las aparentes Paradojas asociadas a la Mecánica Cuántica»!
Un cordial saludo. Con respecto a las «aparentes» Paradojas asociadas a la mecánica Cuántica, resulta que se puede «demostrar» que la causa básica de las mismas radica en que «la unidad de medida de la Constante de Planck adolece (le falta) de un término, que al ser adicionado permite comprender a plenitud el significado físico real de esta»!
Hola, agradecemos mucho tus comentarios para entender temas tan complicados de la mecánica cuántica y de las paradojas pues en si estas son difíciles de entender.
Un cordial saludo. Con respecto a la «unidad de medida» de la Constante de Planck, si tenemos en cuenta que para la «frecuencia» de los fenómenos oscilatorios, la cual tradicionalmente se expresa en la unidad «1/segundo» (por una cuestión de índole práctico a partir de que el período también se denota en la unidad «tiempo»), está bien determinado que la unidad de medida académicamente rigurosa para la «frecuencia» es el «Hz (OSCILACIONES/segundo)» y para el «período» es «tiempo/OSCILACIÓN», con estos antecedentes si ahora queremos expresar la ecuación cuántica de la energía de un fotón ( E = h x f ) usando esta unidad de medida de la «frecuencia» (para lo cual se tiene no solo el derecho sino que resulta ser el planteamiento MÁS CORRECTO ya que conceptualmente la frecuencia es «cantidad de OSCILACIONES/tiempo») entonces , expresando la Energía en «Joules» y el Tiempo en «segundos», y tener ahora que cancelar no solo la unidad «segundo» sino TAMBIÉN la unidad «OSCILACIÓN» entonces a la Constante de Planck le corresponde la unidad de medida «(Joules.segundo)/OSCILACIÓN»!
Hola tienes razón en cuanto a lo tradicional y lo riguroso, en este artículo nos basamos mas en lo tradicional pues solo es una iniciación en este tipos de temas de física, pero tu información es muy interesante y ayuda mucho para aquellos que desean profundizar en lo riguroso, te agradecemos mucho.
Buenas tardes.Por favor me puedes ayudar aplicando la integración o diferencial en la inecuacion de Heisenberg?.Soy cubana